细菌宿主对温和噬菌体“沉默-激活”的机制获新进展
中国科学院南海海洋研究所王晓雪研究员团队发现细菌宿主H-NS蛋白调控原噬菌体的“沉默-激活”过程的新机制。相关研究成果以Xenogeneic silencing relies on temperature-dependent phosphorylation of the host H-NS protein in Shewanella为题于3月8日在线发表于英国Oxford出版社生物学核心期刊Nucleic Acids Research《核酸研究》(最新影响因子11.501)。刘晓晓副研究员为论文第一作者,王晓雪研究员为论文通讯作者。
噬菌体是海洋中最丰富、最多样化的一类病毒。同其他病毒一样,噬菌体依靠宿主进行生存繁殖,细菌和古菌是噬菌体的天然宿主。烈性噬菌体与宿主之间的关系可以称为“捕食者与猎物”,一旦侵染宿主将直接导致宿主细胞裂解并释放大量的噬菌体。温和噬菌体则可选择整合到宿主基因组中,以原噬菌体(prophage)的形式与宿主保持共存的状态,宏基因组的调查发现海洋中半数以上的细菌都感染了温和噬菌体,所形成的原噬菌体可通过提供新的功能而使细菌宿主受益,它们之间的密切关系显著地塑造了二者的生物共进化。王晓雪等前期研究工作中发现原噬菌体在细菌生物膜和宿主应激反应中扮演着重要的角色。然而,一旦原噬菌体受某外因刺激而进入裂解周期,会造成宿主细胞的死亡,因此原噬菌体的激活需受到宿主的严格控制。
希瓦氏属细菌广泛分布于海洋,包括表层海水、深海、极地、热液口等多样的海洋环境。比较基因组学分析发现,原噬菌体、质粒和基因岛等水平基因转移元件是不同环境中希瓦氏属菌基因组的主要差别,是研究环境细菌和原噬菌体共进化的理想模型。王晓雪团队前期研究发现分离于浅层沉积物(Zeng et al., ISME J, 2016)和深海沉积物(Liu et al., EM, 2019)的希瓦氏菌中的原噬菌体,都通过与细菌宿主建立“共生关系”,帮助细菌宿主适应极端环境适应。分离于具有温度交替环境中的希瓦氏菌,其中的原噬菌体在低温条件下会从宿主基因组中发生切离,提高细菌在低温下的存活率,说明在特定的环境条件下对原噬菌体进行沉默-激活决定细菌宿主的命运。
H-NS是细菌宿主编码的一个全局转录抑制因子,其对整合进细菌基因组的原噬菌体进行沉默,并在合适的条件下将原噬菌体激活发挥重要作用。在对数生长期,每个细菌细胞内约含10000-20000个H-NS蛋白,可与DNA上富含AT的区域结合,进而沉默原噬菌体。但不同种类细菌的H-NS如何感知外界环境信号的变化,实现对特定原噬菌体的沉默与激活,一直是细胞生物学、遗传学、结构生物学研究的热点和难点。
刘晓晓等研究发现希瓦氏菌中的H-NS通过识别噬菌体的切离酶对原噬菌体进行“沉默”,H-NS蛋白的磷酸化是“沉默”原噬菌体的关键。常温下,细胞内大部分H-NS蛋白为磷酸化状态,磷酸化H-NS可沉默原噬菌体上具细胞毒性基因的表达;低温促进H-NS去磷酸化,改变H-NS对DNA的结合方式,解除H-NS对特定原噬菌体的沉默,帮助希瓦氏菌适应低温环境。这是首次发现,细菌将外界温度变化转化为细胞内H-NS蛋白磷酸化水平的变化,说明H-NS蛋白的“翻译后修饰”可作为“分子开关”,实现对特定原噬菌体“沉默-激活”的精准调控。研究结果对于我们理解细菌如何“沉默”外源基因并将其整合进宿主中以及细菌与噬菌体的共进化过程提供了新的认识。
研究工作得到国家杰出青年科学基金、基金委水圈微生物重大研究计划重点项目、国家重点研发计划、南方海洋科学与工程广东省实验室(广州)重大专项等团队项目的资助。
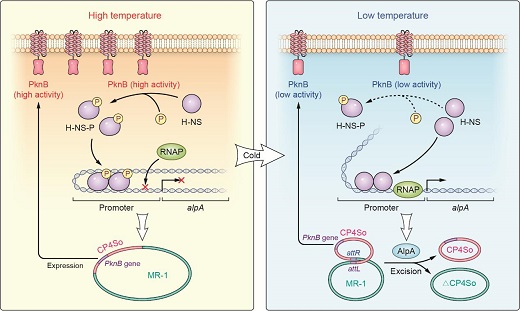
宿主H-NS蛋白对原噬菌体CP4So“沉默-激活”的精确调控机制
附件下载:
 粤公网安备44011502001245号
粤公网安备44011502001245号