研究发现新颖毒素-抗毒素系统具有控制温和噬菌体激活和防御噬菌体的双重功能
8月23日,中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室研究员王晓雪团队联合哈佛医学院Matthew K. Waldor团队,发现了温和噬菌体编码的新颖的三组分的毒素-抗毒素系统,并解析了这一新系统在温和噬菌体溶原裂解转化和噬菌体防御方面的双重功能,相关研究成果以“Control of lysogeny and antiphage defense by a prophage-encoded kinase-phosphatase module”为题,在线发表于《自然-通讯》(Nature Communications)。南海海洋所研究员郭云学、副研究员汤开浩,哈佛医学院Brandon Sit和南海海洋所2022级博士研究生古嘉瑜为该论文共同第一作者,南海海洋所研究员王晓雪和哈佛医学院教授Matthew K. Waldor为该论文的共同通讯作者。合作者还包括哈佛大学Hongbo R. Luo团队。
在微生物世界中,噬菌体(感染细菌的病毒)与宿主之间的相互作用一直是生物学研究的热点。丝状噬菌体广泛存在于自然界中,可以侵染细菌和古菌宿主。假单胞菌属的Pf丝状噬菌体在生物膜形成和毒力中扮演重要角色。然而,关于Pf原噬菌体在生物膜中激活的机制仍是一个谜。揭示这些复杂的生物学过程对于寻找新的治疗策略,发现和认识丝状噬菌体的生物学和生态学功能具有重要的意义。
在这项研究中,研究人员报道了铜绿假单胞菌中的丝状温和噬菌体携带的三组分毒素-抗毒素系统KKP(kinase-kinase-phosphatase)的双重功能。原噬菌体诱导通常通过控制噬菌体阻遏蛋白活性进行调节,例如宿主因子对阻遏蛋白的特异性切割使其失活来激活噬菌体的裂解途径。毒素KK的其中一个靶标是宿主的拟核结合蛋白MvaU。KKP通过激酶和磷酸酶活性之间的平衡控制MvaU的磷酸化水平,从而调控丝状噬菌体的溶原-裂解转化及噬菌体颗粒的产生。此外,研究发现抗毒素活性被烈性噬菌体的复制蛋白抑制,激活毒素KK活性,抑制了烈性噬菌体的繁殖。
KKP的发现将毒素-抗毒素系统引入了宿主-噬菌体相互作用的模型,作为控制温和噬菌体裂解的开关和烈性噬菌体入侵的盾牌,通过可逆翻译后修饰发挥功能,位于环境信号、噬菌体复制和宿主生理状态的交汇中心。 KKP基因簇在超过1000种不同的温和原噬菌体存在。KKP代表了一种基于磷酸化的温和噬体激活和防御噬菌体的机制(图1),揭示了毒素-抗毒素系统是自然界温和噬菌体和烈性噬菌体两大类噬菌体之间博弈的筹码。
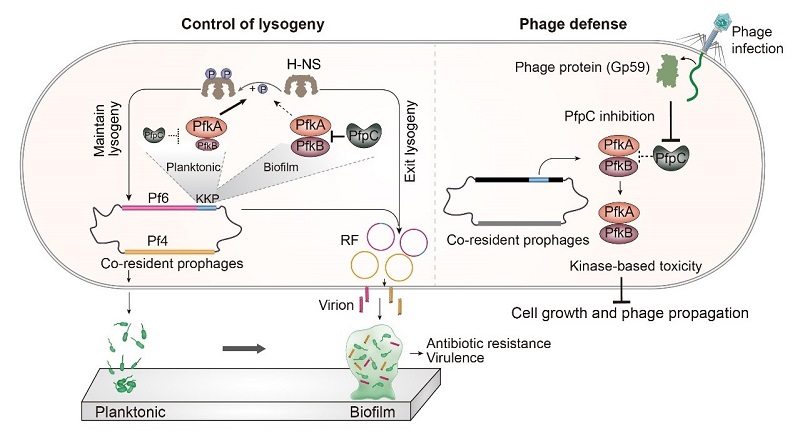 图1. KKP控制温和噬菌体的溶原裂解转化和抵抗烈性噬菌体入侵的机制
图1. KKP控制温和噬菌体的溶原裂解转化和抵抗烈性噬菌体入侵的机制
本研究工作得到国家自然科学基金、国家科技部重点研发计划、广东省本土创新团队等项目的资助。
相关论文信息:Yunxue Guo#, Kaihao Tang#, Brandon Sit#, Jiayu Gu#, Ran Chen, Xinqi Shao, Shituan Lin, Zixian Huang, Zhaolong Nie, Jianzhong Lin, Xiaoxiao Liu, Weiquan Wang, Xinyu Gao, Tianlang Liu, Fei Liu, Hongbo R. Luo, Matthew K. Waldor*, Xiaoxue Wang*. Control of lysogeny and antiphage defense by a prophage-encoded kinase-phosphatase module. 2024, 15(1):7244. doi: 10.1038/s41467-024-51617-x.
附件下载:
 粤公网安备44011502001245号
粤公网安备44011502001245号