研究发现逆转录酶通过重编辑温和噬菌体的基因组赋予其超感染能力
近日,中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室王晓雪研究员团队发现逆转录酶通过“重编辑”温和噬菌体的基因组赋予其超感染能力,具有超感染能力的噬菌体在生物膜中实现快速增殖。相关研究成果以“A reverse transcriptase controls prophage genome reduction to promote phage dissemination in Pseudomonas aeruginosa biofilms”为题,10月20日在线发表于Cell子刊Cell Reports。南海海洋所研究员郭云学,2022级博士研究生林世团为该论文共同第一作者,研究员王晓雪为通讯作者。
在生物界的漫长进化历程中,逆转录酶的发现改变了对遗传信息传递方式的认识。在许多真核生物中,端粒酶逆转录酶通过逆转录将端粒DNA加至真核细胞染色体末端,填补DNA复制损失的端粒,以保护基因组的完整性。在逆转录病毒(RNA病毒)中,逆转录酶将病毒RNA逆转录合成双链DNA,双链DNA被整合酶整合至宿主细胞染色体DNA上形成前病毒,并可随宿主细胞分裂传递给子代细胞。
研究团队发现单链DNA病毒-丝状噬菌体的基因组携带了逆转录酶,通过对生物膜形成中的丝状噬菌体“释放-再次侵染”过程的详细解析,意外的发现该逆转录酶负责合成了一个精简的丝状噬菌体基因组,舍弃了约1/3的基因组。这个重编辑的噬菌体基因组保留了噬菌体组装的必需基因,并截获激活因子上游ncRNA的强启动子确保噬菌体激活因子及其下游基因的高表达,重编辑的噬菌体基因组还丢掉了免疫调控区,具有了“超感染”能力。在生物膜形成过程中,重编辑的噬菌体能够取代一部分宿主菌中的温和噬菌体,成为不断产生超感染噬菌体的“超级宿主菌”。“超级宿主菌”不仅能大量产生超感染性噬菌体,还表现出对超感染性噬菌体的抵抗能力,进而维持生物膜的结构稳定性,以及生物膜中噬菌体与宿主菌比例的平衡(图1)。研究结果证实,添加逆转录酶抑制剂能够有效地抑制生物膜中超感染噬菌体的产生。研究的不足之处在于本项研究中还未能直接构建“重编辑噬菌体基因组” 体外反应体系,研究团队还在继续相关的尝试。
逆转录酶对DNA病毒基因组编辑功能的这一发现,拓展了人们对噬菌体生物学特征及生物膜中噬菌体与宿主菌复杂互作的微观认识。近年来,融合CRISPR/Cas9 切口酶的工程化逆转录酶以及反转录子中的逆转录酶展现出作为真核生物基因组编辑工具的巨大潜力,为治疗遗传性疾病和开发定制化治疗方案提供了新的可能性。丝状噬菌体的逆转录酶的应用前景也值得探究。
本研究工作得到国家自然科学基金、国家科技部资源调查专项、广东省本土创新团队等项目和南海海洋所基础前沿与创新发展 “一体化”项目的资助。
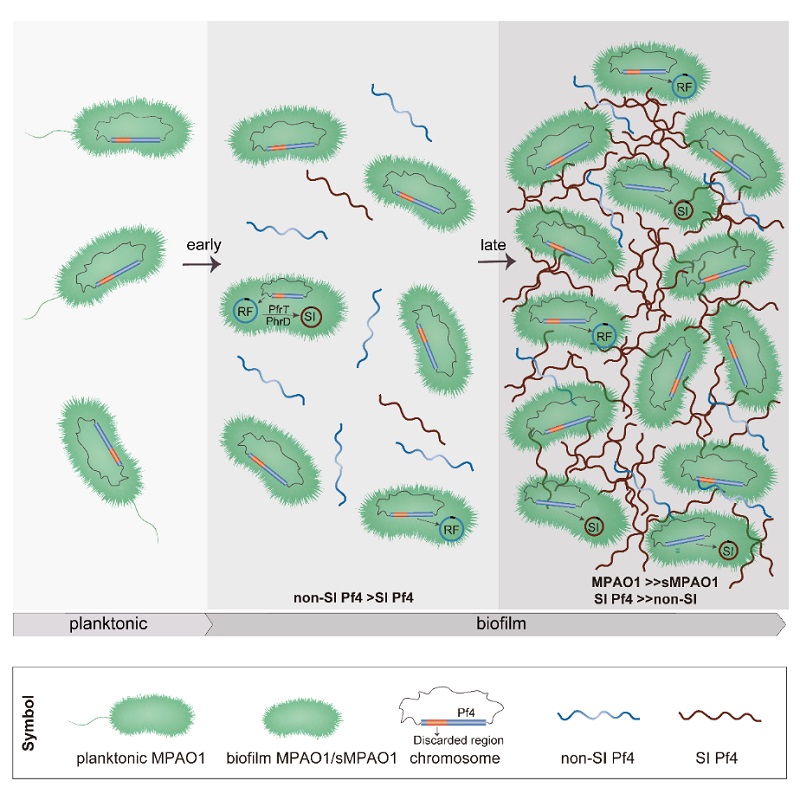
图1. 逆转录酶控制超感染噬菌体Pf4的产生及其在生物膜中扩散模式图。RF Pf4:复制型Pf4; SI Pf4:超感染Pf4。
相关论文信息:Guo Yunxue #, Lin Shituan#, Chen Ran, Gu Jiayu, Tang Kaihao, Nie Zhaolong, Huang Zixian, Weng Juehua, Lin Jianzhong, Liu Tianlang, Matthew K. Waldor, Wang Xiaoxue*. A reverse transcriptase controls prophage genome reduction to promote phage dissemination in Pseudomonas aeruginosa biofilms. 2024, Cell Reports, 43(11): 114883.
论文链接:doi.org/10.1016/j.celrep.2024.114883
附件下载:
 粤公网安备44011502001245号
粤公网安备44011502001245号