PNAS发文揭示细菌复杂鞭毛马达结构的新组分
中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室高贝乐研究员团队联合耶鲁大学医学院Jun Liu团队,揭示了细菌复杂鞭毛马达结构的新组分,丰富了对定子-转子相互作用复杂性的理解。相关成果以“Tetrameric PilZ protein stabilizes stator ring in complex flagellar motor and is required for motility in Campylobacter jejuni”为题,发表于国际著名综合性期刊PNAS。中国科学院南海海洋研究所2020级博士生陈园园和耶鲁大学医学院Shoichi Tachiyama为共同第一作者,研究员高贝乐为通讯作者。
细菌鞭毛马达是首个被发现的生物旋转机器,其驱动力由定子单元MotAB通过消耗离子动力势提供。MotAB的同源蛋白参与多种重要的细胞生命过程,研究鞭毛马达有助于加深我们对这类旋转复合体的理解。在鞭毛马达“齿轮传动”模型中,定子作为小型的主动齿轮驱动大型被动齿轮转子的旋转。近期多项研究发现,在模式物种E. coli和S. enterica以外的许多物种中存在额外的周质支架蛋白,这些蛋白能稳定并形成更宽的定子环以产生更大的扭矩。然而,迄今尚无报道表明胞质侧存在能与定子形成稳定复合物的支架蛋白。
研究团队揭示,位于胞质侧的FlgX蛋白构成空肠弯曲杆菌复杂鞭毛马达结构的新组分,能够与MotA的胞质部分相互作用并稳定马达中的定子环。结构分析表明,FlgX属于四聚体PilZ家族,但与其他作为c-di-GMP受体的PilZ家族蛋白不同,研究显示FlgX不具备c-di-GMP结合能力,表明其在空肠弯曲杆菌中独立于c-di-GMP调控发挥功能。此外,胞质侧还发现了新的球形密度结构,将两个FlgX连接在一起,而蛋白组分尚不清晰。FlgX或定子单元的缺失均会导致周质空间中FliL环和笼状结构的不完整,这表明FlgX-定子复合体的组装可能早于FliL环和笼状结构的形成。对弯曲菌门的进化分析显示,FlgX与该门祖先的F3趋化系统绑定出现,表明FlgX极有可能是从该门的共同祖先中进化而来。
FlgX四聚体在鞭毛马达中的特殊位置增加了我们对定子-转子相互作用复杂性的理解。其作为鞭毛马达结构组分,独立于c-di-GMP的调控发挥功能,也代表了PilZ超家族一种新的功能分化。此外,对复杂马达结构、功能和进化的深入分析为大分子机器的理性设计提供了重要的理论依据。
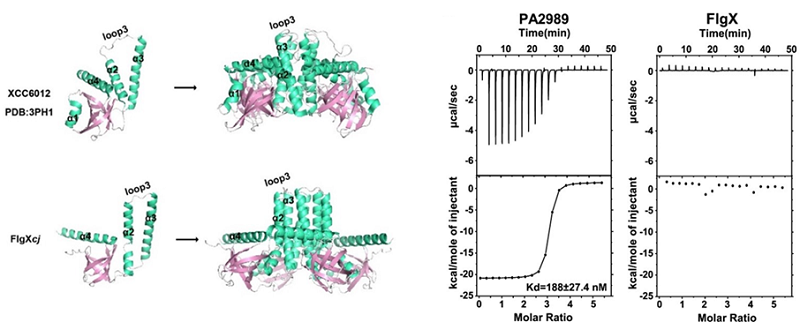
图1 FlgX具备四聚体PilZ特征且不能结合c-di-GMP
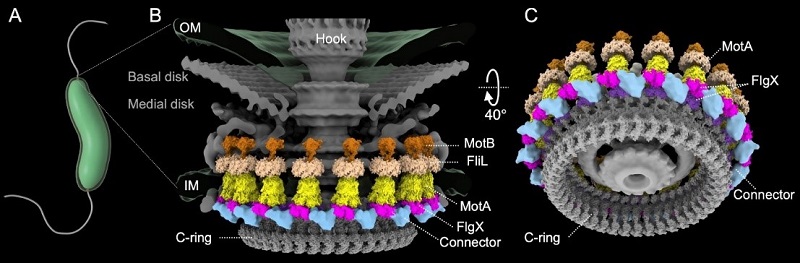
图2 空肠弯曲杆菌FlgX-MotA复合体的假原子模型
本研究得到了南沙群岛珊瑚礁生态系统国家野外科学观测研究站开放基金、国家重点研发计划、国家自然科学基金、广东省科技计划项目、南方海洋科学与工程引进人才团队重点专项广东省实验室(广州),以及中国科学院南海生态环境工程创新研究院的资助。
相关论文信息:https://www.pnas.org/doi/10.1073/pnas.2412594121
附件下载:
 粤公网安备44011502001245号
粤公网安备44011502001245号